Журнал “Косметика и медицина” • 2/2019
Троценко Татьяна Викторовна, врач-дерматовенеролог, косметолог, ведущий специалист, ООО «Астрея», Москва
В условиях городской жизни кожа подвергается действию многочисленных факторов, ускоряющих процесс естественного старения. Основные две группы веществ, способные оказать помощь в противостоянии фотостарению — антиоксиданты и регуляторы клеточного цикла. Косметические средства, созданные на основе запатентованных технологий SCA® и EDAFENCE® (Cantabria Labs, Испания), содержат комплекс биологически активных агентов, способных противостоять фотостарению кожи.
СТАРЕНИЕ НЕМИНУЕМО, НО… ВСЕМУ СВОЕ ВРЕМЯ!
Старение кожи является следствием внутренних генетически запрограммированных и внешних средовых факторов. Естественный механизм старения сопряжен с остановкой роста клеток после определенного числа делений (критерий Хейфлика). Причиной этого служит укорочение теломер при каждом делении. Внешние неблагоприятные факторы, в особенности такой сильный агрессор, как ультрафиолетовое (УФ) излучение, способны прямым и непрямым способом повреждать генетический аппарат клеток кожи — дезоксирибонуклеиновую кислоту (ДНК). ДНК дирижирует всеми важными процессами жизнедеятельности клеток, включая обмен веществ и пролиферацию. Повреждение ядерной и митохондриальной ДНК клеток кожи ведет к структурным и функциональным нарушениям.
Возрастные изменения кожи
• Ослабление барьерной и терморегуляционной функций кожи. Ослабление пролиферативной способности кератиноцитов ведет к истончению эпидермиса. Уплощение границы между эпидермисом и дермой снижает сопротивление внешним факторам. Снижение синтеза липидов повышает вероятность ксероза, воспалительных высыпаний. Падение функциональной активности потовых желез приводит к нарушению терморегуляции и переносимости высоких температур [1–2].
• Ослабление регенерационной способности кожи, в том числе из-за дисфункции потовых желез, где располагаются стволовые клетки, участвующие в процессе заживления ран.
• Снижение продукции меланина, неравномерное распределение пигмента. На каждое десятилетие жизни приходится снижение продукции меланина на 10–20%. Локальное усиление пигментации происходит в основном в результате повышения числа ДОФА-положительных меланоцитов в базальном слое эпидермиса.
• Общее снижение чувствительности кожи, сопряженное с уменьшением числа нервных окончаний в эпидермисе и дерме.
• Дисрегуляция иммунного ответа. Количество клеток иммунной системы в коже с возрастом не уменьшается, однако снижается их способность к фагоцитозу, миграции в лимфатические узлы и стимуляции Т-клеток.
• Снижение васкуляризации, особенно в верхних слоях дермы. Согласно исследованиям, максимальный кровоток в коже — показатель функциональной способности эндотелиальной системы реагировать на повышение температуры — уменьшается линейно с возрастом.
• Перераспределение подкожно-жирового слоя между разными зонами лица, нарушение обмена веществ в адипоцитах и синтеза адипокина.
• Структурные изменения кожи, ведущие к потере упругости, эластичности, механического сопротивления.
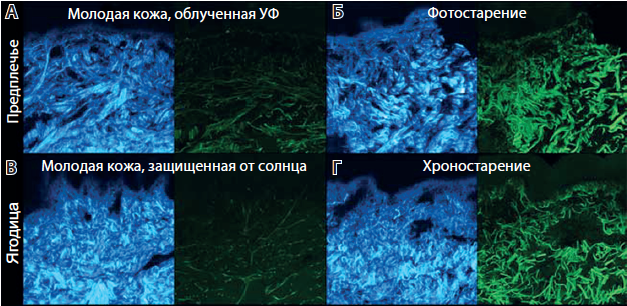
В основе патогенеза старения кожи ключевое место принадлежит накоплению в дерме поврежденных, дефектных коллагеновых и эластиновых волокон [3]. С возрастом и под действием неблагоприятных внешних факторов происходит активизация разрушения коллагена, сопровождаемая гипоколлагеногенезом, что приводит к снижению количества коллагена I и III типов (рис. 1).
Рис. 1. Возрастные изменения коллагено- вых (голубой цвет) и эластиновых (зеле- ный цвет) волокон. А — кожа 25-летнего субъекта; Б — кожа 54-летнего субъекта; В — кожа 35-летнего субъекта; Г — кожа 83-летнего субъекта. В молодом возрас- те для дермы характерна развитая сеть коллагеновых волокон (А, В), в то время как при фото- и хроностарении количе- ство коллагеновых волокон уменьшено и они фрагментированы, в верхних слоях дермы отсутствуют мелкие эластиновые волокна, происходит накопление конгло- мератов эластиновых волокон (Б, Г) [3]
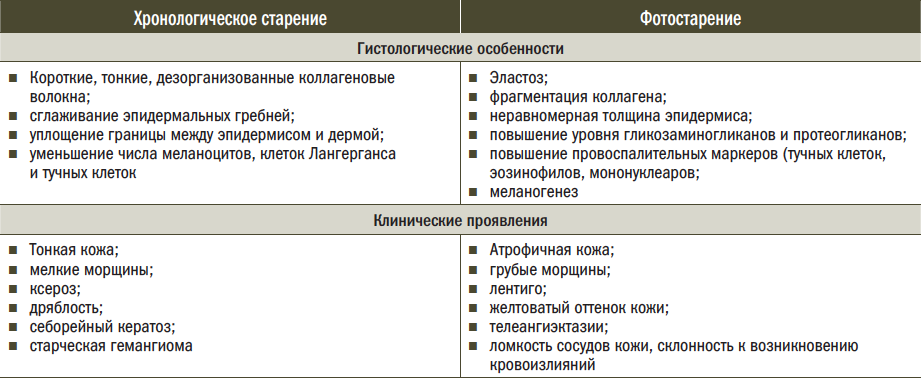
Хроно- и фотостарение несколько отличаются по клиническим проявлениям, однако их биохимические и морфологические черты схожи между собой
(табл. 1).
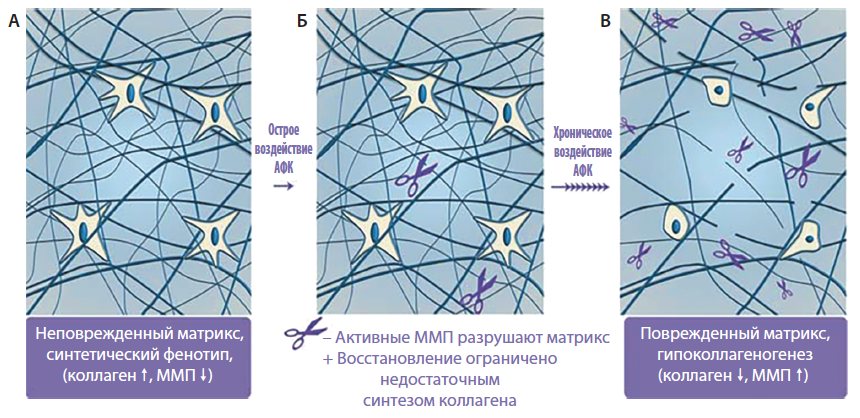
Естественный процесс старения кожи ускоряется и усугубляется действием внешних деструктивных факторов, доминирующая роль среди которых принадлежит УФ-излучению, способному нанести ощутимый ущерб коже [3]. УФ-А (320–400 нм) индуцирует образование активных форм кислорода (АФК), повреждающих цепи ДНК. УФ-В (290–320 нм) напрямую взаимодействует с эпидермальными цитокинами, что приводит к мутагенезу ДНК и формированию циклобутановых димеров. УФ-излучение активирует митоген-активированную протеинкиназу (МАПК), замедляющую формирование проколлагена I. Повышение экспрессии матриксных металлопротеиназ (ММП) вызывает усиление деградации внеклеточного матрикса, в особенности проколлагена l и lll (рис. 2). УФ-излучение оказывает ингибирующее действие на трансформирующий фактор роста β (ТФР-β), что приводит к снижению синтеза коллагена. Хотя некоторый компенсаторный синтез коллагена в ответ на УФ-излучение все же происходит, повторяющееся УФ-воздействие приводит к образованию «солнечных рубцов» и в дальнейшем видимых изменений — морщин. Парадоксальным действием обладает УФ-излучение на ангиогенез. При остром воздействии происходит индукция ангиогенеза через активацию сосудистого эндотелиального фактора роста и снижение активности тромбоспандина — потенциального ингибитора ангиогенеза. Однако для новообразованных сосудов характерна повышенная проницаемость, что влечет за собой высвобождение провоспалительных медиаторов, таких как ИЛ-8, и запуск воспалительной реакции, усугубляющей разрушение внеклеточного матрикса. При постоянном воздействии УФ-излучения кровоснабжение кожи ухудшается.
Таблица 1. Сравнительная характеристика признаков фото- и хроностарения [1]
Рис. 2. Накопление фрагментированных коллагеновых волокон приводит к снижению синтеза коллагена при хроно- и фотостарении. А — в молодой коже неповрежденные коллагеновые волокна обеспечивают механическое сопротивление, фибробласты способны растягиваться, происходит активный синтез коллагена. Б — под воздействием УФ-излучения (фотостарение) или в результате окислительного стресса (хроностарение) повышение АФК активирует сигнальные каскады, приводящие к снижению синтеза коллагена и активации ММП, разрушающих коллагеновые волокна. В — накопление фрагментированных коллагеновых волокон нарушает структурные и функциональные свойства дермального внеклеточного матрикса [3]
ПОЛЛЮТАНТЫ — НЕВИДИМЫЕ ВРАГИ НАШЕГО ЗДОРОВЬЯ
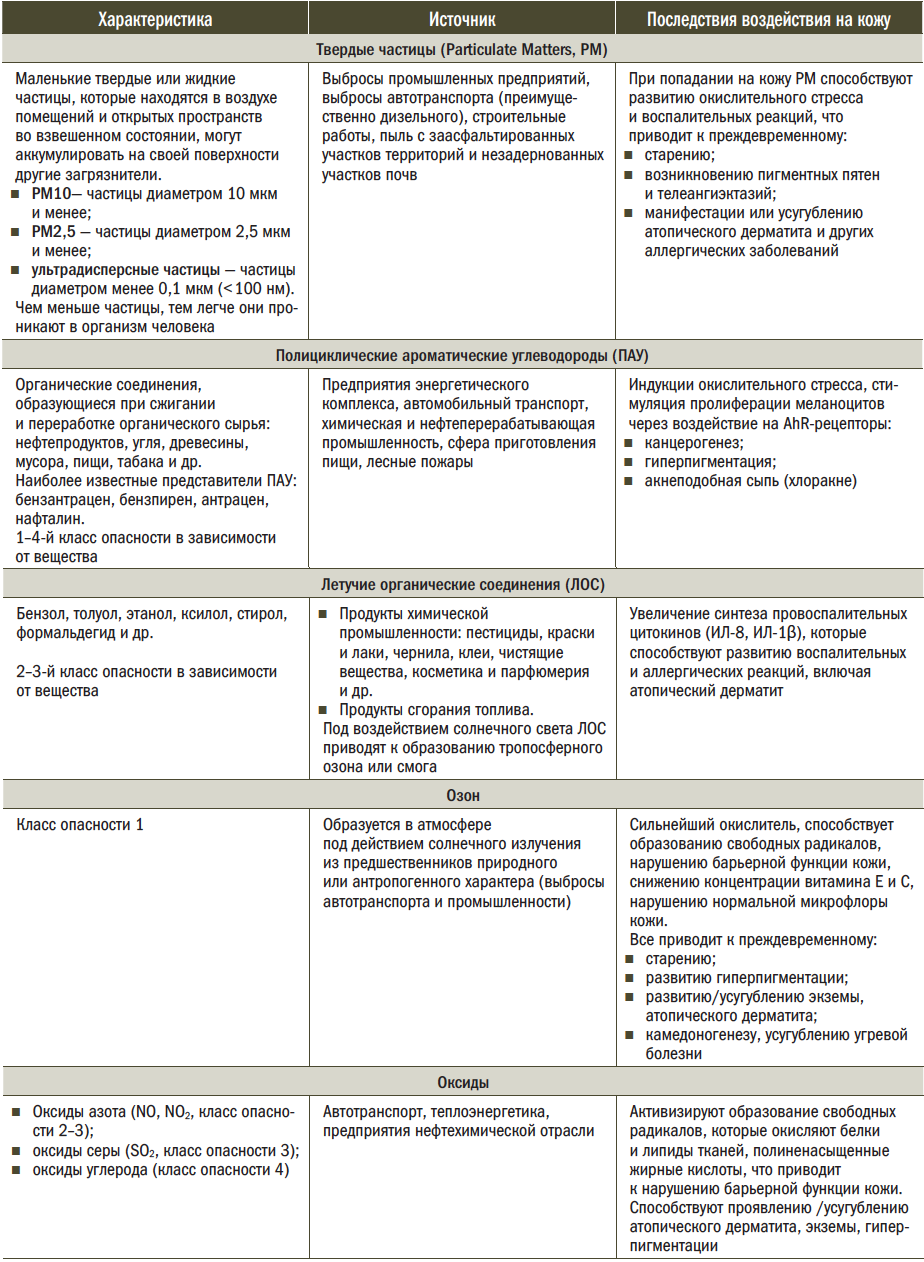
Не менее опасным является воздействие на кожу таких агрессивных внешних факторов, как загрязнители. К загрязнителям относят любые агенты физического, химического или биологического характера, содержащиеся в природной среде в количествах, превышающих их фоновые (средние за много лет) значения и приводящие к негативным последствиям. Загрязнители оказывают повреждающее действие на кожу через индукцию образования свободных радикалов, запуск воспалительного каскада в коже, нарушение микрофлоры кожи. Отдельные поллютанты выступают в качестве лигандов рецептора к фактору транскрипции, регулирующему клеточную пролиферацию, воспалительные процессы, меланогенез, — AhR. Его активация ведет к запуску обменных реакций, способствующих накоплению токсинов клетками нашего организма. Другие виды поллютантов стимулируют провоспалительные реакции, что приводит к повышению уровня ИЛ-1 β, ИЛ-6 и ИЛ-8, которые, в свою очередь, активируют хемотаксис гранулоцитов и фагоцитоз
(табл. 2). Следствием хронического воспаления является фиброз: соединительная ткань замещает функциональные элементы органов и тканей.
Воздействовать на патологическое состояние можно на трех уровнях:
• этиологическом (устранение причины);
• патогенетическом (блокировка механизмов реализации патологического эффекта);
• симптоматическом (борьба со следствием патологического процесса).
Устранить причину фотостарения не представляется возможным. Большинству из нас выпал жребий городской жизни, и каждый день на улице и внутри помещений нам придется сталкиваться с многочисленными поллютантами. Остается возможность организовать свой образ жизни для минимизации деструктивного воздействия загрязненной окружающей среды. Кожа наряду с легкими первой встречается с химическими загрязнителями и УФ излучением и поэтому нуждается в особой заботе.
Таблица 2. Характеристика основных поллютантов, вносящих свой вклад в процесс фотостарения [5]
EDAFENCE®: УРОКИ ВЫЖИВАНИЯ В АГРЕССИВНОЙ ОКРУЖАЮЩЕЙ СРЕДЕ ОТ DESCHAMPSIA ANTARCTICA
В природе в агрессивных условиях окружающей среды выживают виды живых организмов, способных адаптироваться к неблагоприятным факторам.
Луговик антарктический (Deschampsia antarctica, D. antarctica) — трахеофит, способный процветать в экстремальных условиях, включая суровый климат, высокое давление кислорода, агрессивное солнечное излучение. D. antarctica является одним из двух цветущих растений, успешно колонизировавших береговую часть Антарктики. Своей устойчивостью луговик антарктический частично обязан вторичным путям метаболизма, которые обеспечивают растение фотозащитными соединениями, а также фенольными веществами с сильным антиоксидантным потенциалом, включая флавоноиды, такие как апигенин и лютеолин.
D. antarctica способен эффективно обезвреживать свободные формы кислорода благодаря имеющимся антиоксидантным системам.
• Ферментная система: супероксиддисмутаза катализирует дисмутацию супероксида кислорода (O2-) в пероксид водорода (H2O2), затем каталаза, аскорбат пероксидаза и общая пероксидаза преобразуют пероксид водорода в воду (H2O).
• Неферментная система включает вещества с антиоксидантными свойствами и прямой способностью поглощать УФ-В волны, выполняя роль фотозащитных фильтров: фенольные компоненты, флавоноиды, эфиры гидроксикоричной кислоты.
Луговик антарктический синтезирует значительное количество каротиноидов, таких как зеаксантин и другие промежуточные соединения ксантофильного цикла, представляющих собой «аварийные клапаны», которые
защищают фотосистемы от световых «перегрузок» [7].
Специалистами концерна Cantabria Labs по специальной запатентованной технологии был получен экстракт D. antarctica EDAFENCE® (EDA®). Особая технология экстракции обеспечивает получение и сохранение биологически активных компонентов: флавоноидов, феноловых кислот, хинной кислоты, поли-, олиго- и моносахаридов.
Исследования растворимых экстрактов D. antarctica подтверждают, что эти ценные биологические эффекты могут быть реализованы в клетках человека. Учеными из Испании были проведены исследования защитных свойств EDA® против УФ-А, УФ-В и 2,3,7,8-тетрахлордибензодиоксина (ТХДД) — одного из самых токсичных веществ антропогенного происхождения, образующегося в результате антропогенных процессов, происходящих при температурах свыше 200 °С, таких как сгорание топлива, нефтепродуктов, сжигание бытовых отходов, мусора, производство хлорорганических пестицидов, целлюлозы [8].
Влияние EDA® на неповрежденные фибробласты и кератиноциты человека
Фибробласты человека линии HDF и кератиноциты человека линии HaCaT были инкубированы по отдельности с EDA® на протяжении 24 ч, что не оказало влияния на морфологию и пролиферацию клеток. Некоторое усиление пролиферации наблюдалось при инкубации на протяжении 24–48 ч. Таким образом, EDA® не оказывает существенного влияния на физиологию здоровой культуры клеток.
EDA® против УФ-излучения
Фибробласты и кератиноциты были подвергнуты облучению УФ-А и УФ-В, что вызвало существенное изменение морфологии и пролиферационной активности клеток.
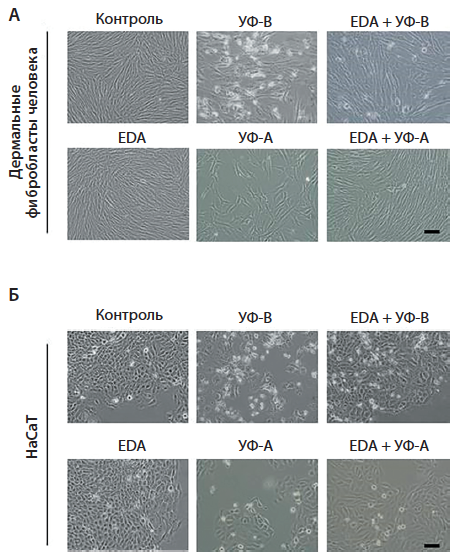
Предварительная инкубация фибробластов и кератиноцитов с 0,5 мг/мл EDA® значительно уменьшила выраженность повреждений в обеих культурах клеток, что свидетельствует о фотопротекторных свойствах EDA® (рис. 3).
Рис. 3. Морфология клеток линии HDF и HaCaT после инкубации с EDA® и/или УФ-облучения. HDF (А) и HaCaT (Б) были инкубированы с 0,5 мг/мл EDA® на протяжении 24 ч и затем облучены УФ-В (700 мДж/см2 для HDF и 300 мДж/см2 для HaCaT) или УФ-А (3000 мДж/см2). Культуры клеток были исследованы через 48 ч [8]
Влияния EDA® на восстановление клеток после УФ-облучения
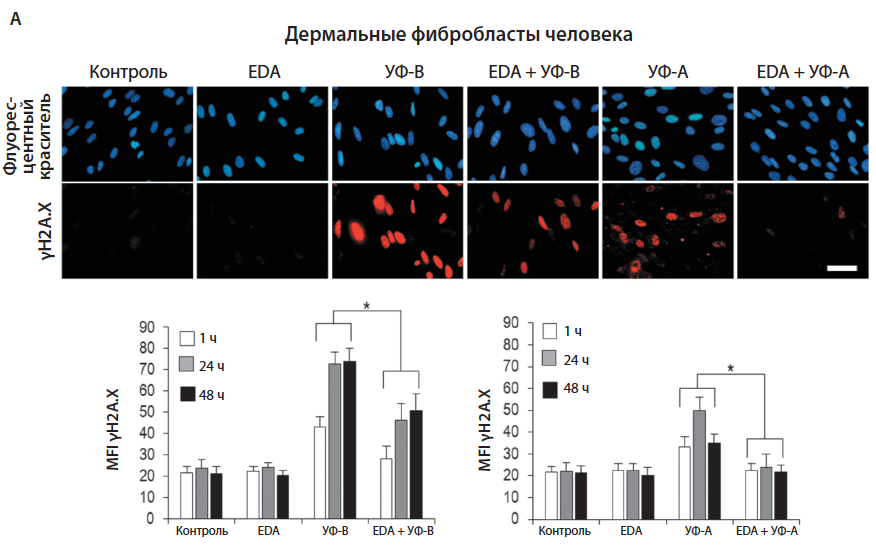
Под воздействием УФ-А и УФ-В наблюдалось усиление экспрессии в ядрах клеток гистонового маркера повреждения ДНК — γH2A.X, в особенности после облучения УФ-В. Инкубация клеток с EDA® не вызывала усиления экспрессии γH2A.X по сравнению с контролем. Однако предварительная инкубация с 0,5 мг/мл EDA® на протяжении 24 ч существенно снижала экспрессию гистонового маркера после облучения УФ-излучением (рис. 4).
Рис. 4. Экспрессия γH2A.X в клетках HDF (А) и HaCaT (Б). Фибробласты и кератиноциты были инкубированы с 0,5 мг/мл EDA® на протяжении 24 ч и затем облучены УФ-В (700 мДж/см2) или УФ-А (3000 мДж/см2). Экспрессия γH2A.X была исследована через 1,24 и 48 ч после облучения. Графики показывают изменение интенсивности флуоресценции (ИФ) γH2A.X через 1, 24, 48 ч после облучения УФ-В (левый график) и УФ-А (правый график) [8]
Влияние EDA® на уровень поли (АДФ-рибозы)-полимеразы (PARP)
PARP объединяет ферменты, участвующие в репарации повреждений ДНК и ремоделировании хроматина за счет поли-АДФ-рибозилирования гистонов. Повреждение клеток под воздействием УФ-В сопровождалось истощением PARP. Предварительная инкубация клеток с EDA® защищала клетки от фототоксичности и предотвращала истощение PARP.
EDA® и уровень каспазы-3
Каспаза-3 имеет много красочных псевдонимов. Ее неслучайно нарекли «киллеровой» протеазой или «палачом апоптоза». В процессе апоптоза каспаза-3 участвует в большинстве протеолитических реакций. Инкубация клеток с EDA® значительно снижала экспрессию каспазы-3 в фибробластах и кератиноцитах после облучения УФ-В и УФ-А [6].
EDA® и уровень ММП1
Облучение УФ-В вызывало значительное повышение уровня ММП1 в культурах кератиноцитов и фибробластов. При инкубации клеток с EDA® после облучения наблюдаемый уровень ММП1 оказался на порядок ниже.
На основе полученных результатов можно рассматривать EDA® в качестве безопасного активного агента, способного обеспечить защиту от повреждающего действия УФ-облучения и улучшить гомеостаз и выживаемость кератиноцитов и фибробластов в условиях воздействия ионизирующего излучения.
EDA® предотвращает вызванную ТХДД активацию AhR в кератиноцитах и фибробластах и сохраняет экспрессию лорикрина в кератиноцитах
Воздействие ТХДД на культуры фибробластов и кератиноцитов in vitro в концентрации 10 нМ на протяжении 1,5 ч вызывало повышение экспрессии AhR. Предварительная инкубация клеток с EDA® перед УФ-облучением привела к дефосфорилированию нуклеоцитоплазматического челнока AhR.
Таким образом, EDA® способен противостоять повышению экспрессии и активации AhR под воздействием УФ-излучения.
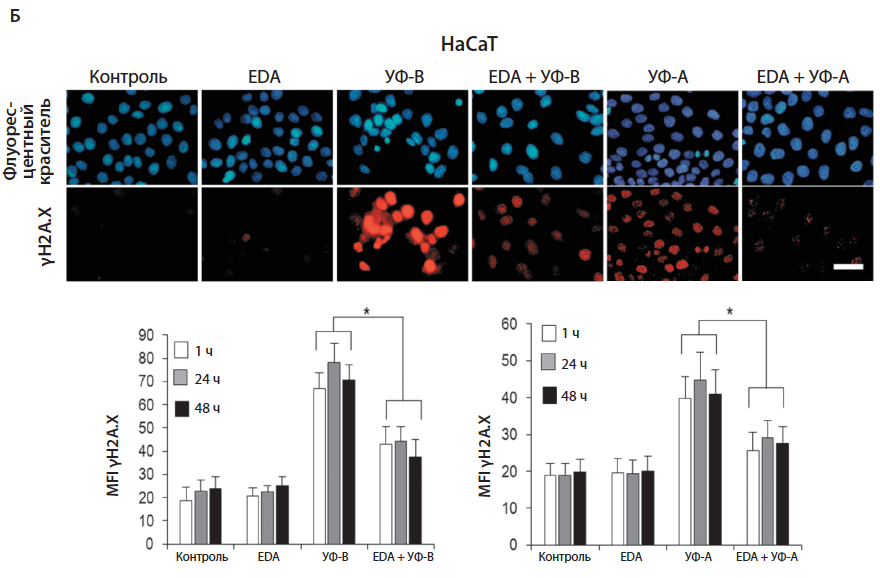
Лорикрин составляет основную часть белкового компонента роговой оболочки. Под воздействием ионизирующего излучения нарушается клеточный гомеостаз и, как следствие, снижается экспрессия лорикрина в кератиноцитах. Предварительная инкубация кератиноцитов перед воздействием ТХДД сохраняет уровень лорикрина в пределах нормы (рис. 5).
Рис. 5. Экспрессия лорикрина в кератиноцитах под воздействием ТХДД и EDA. Клетки HaCaT были инкубированы с EDA® (0,5 мг/мл) на протяжении 24–48 ч с последующей инкубацией с ТХДД (10 нМ) на протяжении 1,5 или 3 ч. В последующем уровень лорикрина был оценен при помощи иммунофлуоресценции: наглядное изображение (А), график средних значений ИФ лорикрина (Б) [8]
Таким образом, EDA® ослабил признаки повреждения ДНК под воздействием УФ и вторичных стрессовых/проапоптотических сигналов, таких как аутофагия, активация каспаз и секреция ММП1. Подобные защитные эффекты не зависели от клеточного цикла. EDA® также снизил обусловленную ТХДД активацию и ядерную транслокацию AhR в клетках кожи. Благодаря своим антиоксидантным свойствам EDA® нивелировал вызванное ТХДД снижение экспрессии лорикрина в кератиноцитах — маркера здоровой терминальной дифференциации ороговевающего эпителия. EDA® выступает в качестве средства фармакологической защиты здоровья кожи против ионизирующего излучения, фотостарения и канцерогенеза.
SCA®: АНТИОКСИДАНТНАЯ ЗАЩИТА + ВОССТАНОВЛЕНИЕ
Еще одним ценным источником биологически активных веществ является секрет улиток Cryptomphalus aspersa (C. aspersa). Фермеры, выращивавшие съедобных улиток, заметили, что их слизь хорошо заживляет раны и смягчает кожу. Именно эта необычайная способность привела к первым исследованиям, проведенным доктором Рафаэлем Абадом (рентгенологом) по лечению кожных поражений пациентов, проходящих лучевую терапию, где клинически наблюдался мощный антиоксидантный и восстановительный эффект секрета C. aspersa [9].
Специалистами концерна Cantabria Labs с помощью запатентованного процесса была получена гликопротеиновая композиция SCA® с выраженным регенеративным действием. С 1970-х гг. SCA® успешно применялся у пациентов с лучевым дерматитом и хроническими ранами.
Позже в ходе исследований in vitro были обнаружены антиоксидантные свойства препарата, в частности способность связывать АФК.
Основные биологические эффекты входящих в состав SCA® гликозаминогликанов и факторов роста:
• стимуляция производства коллагена, эластина и гиалуроновой кислоты;
• стимуляция миграции и пролиферации фибробластов;
• восстановление морфологии фибробластов;
• ингибирование плазмина;
• регулирование уровня лорикрина и десмоглеина 1;
• обновление и реорганизация внеклеточного матрикса [10].
Важно подчеркнуть, что процесс получения биологического материала не сопряжен с повреждением улиток: их стимулируют на выработку секрета, который в последующем собирается, фильтруется и тестируется на чистоту и активность.
Согласно клиническим исследованиям, местное нанесение SCA® способно устранять признаки фотостарения, повышать толщину кожи. Кожа становится более гладкой, уменьшается глубина морщин (табл. 3).
SCA® является активным ингредиентом антивозрастной косметической линии Endocare, разработанной специально для коррекции признаков фотостарения и восстановления кожи после агрессивных косметических процедур (лазер, пилинг, дермабразия и др.).
Таблица 3. Результаты последних исследований клинической эффективности средств, содержащих биологически активные вещества из секрета и яиц C. aspersa [10–14]
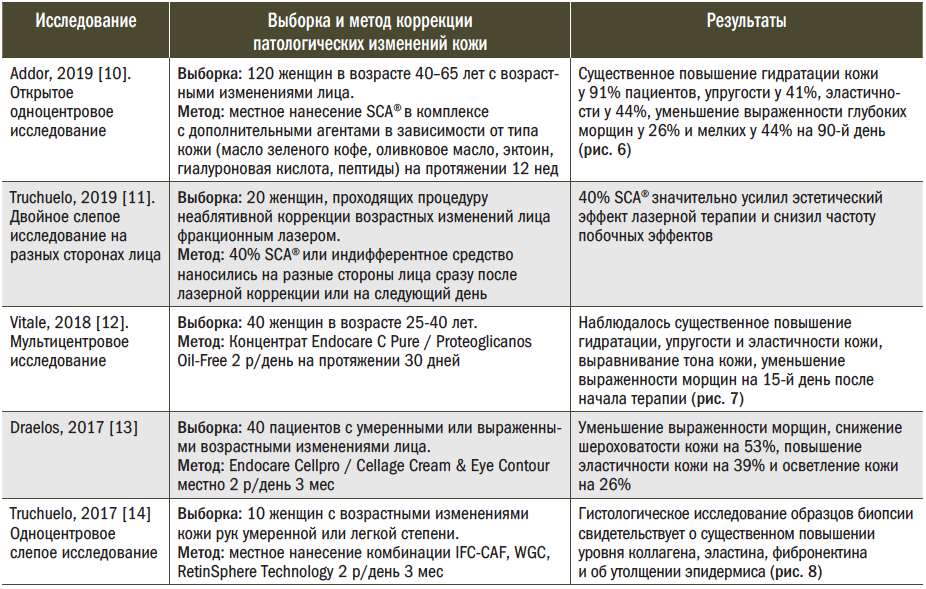
Рис. 6. Снимок дермы (конфокальная рефлекционная микроскопия): А — исходное состояние; Б — увеличение числа коллагеновых волокон на 90-й день терапии [10]
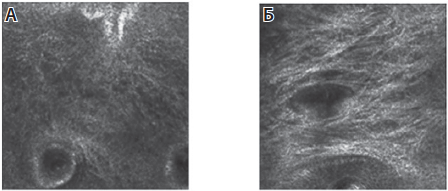
Рис. 7. Уменьшение глубины морщин на 15-й и 30-й день применения Endocare C Pure / Proteoglicanos Oil-Free [11]
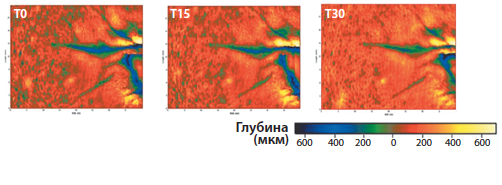
Рис. 8. Иммуногистохимическое окрашивание, свидетельствующее о повышении числа эластиновых волокон (Б) по сравнению с исходнымсостоянием (А), коллагена III (Г) по сравнению с исходным состоянием (В) и фибронектина (Е) по сравнению с исходным состоянием (Д) в результате местного применения комплекса препаратов (IFC-CAF, WGC, RetinSphere Technology), содержащего фактор активации клетокиз яиц Cryptomphalus aspersa [14]
ЗАКЛЮЧЕНИЕ
Уход за кожей в условиях большого города для поддержания здоровья, коррекции и профилактики признаков фотостарения требует тщательности и комплексного подхода. Простое умывание водой позволяет убрать до 65% секрета сальных желез и осевших на поверхности кожи загрязнений, однако этого недостаточно для полной очистки. Одновременное очищение, увлажнение, антиоксидантную защиту и восстановление могут обеспечить косметические средства, содержащие биологически активные агенты природного происхождения. Как показывают клинические исследования, линии средств Endocare и Neoretin Rejuvemax отлично справляются с поставленными целями.
Скачать статью в pdf