Журнал “Косметика и медицина” • 2/2017
Троценко Татьяна Викторовна, врач-дерматокосметолог, ведущий специалист ООО «АСТРЕЯ»
Жизнь большинства земных организмов зависима от солнечного излучения. И человек никогда не появился бы, не потрудись древние фотосинтетики над насыщением атмосферы кислородом и созданием озонового слоя Земли. Озоновый экран, поглощающий самый губительный, жесткий ультрафиолет (УФ), позволил растениям покинуть воды Мирового океана и расселиться на суше, создав необходимые условия для развития наземных форм жизни. Если говорить о человеке, то он поддерживает работу своего организма пищей, создаваемой благодаря превращениям световой энергии в биосфере, без УФ-облучения он не способен производить собственный витамин D и от долгой нехватки света впадает в депрессию. Однако за регулярные солнечные ванны приходится платить фотостарением, ожогами, гиперпигментацией, аллергическими реакциями и даже раком.
Активный поиск веществ, нивелирующих причиняемый солнцем вред, привел к созданию косметических средств с минеральными, химическими и биологическими «солнечными фильтрами» (sunscreens), не позволяющими определенным частям электромагнитного спектра проникать в кожу [1]. Но внешние фильтры не могут на 100% защитить даже ту небольшую часть человечества, которая с ними знакома: мешают строгие правила их нанесения, ограничения по длинам «фильтруемых» волн и стабильности, аллергические реакциии даже тон кожи. Поэтому в последние годы особое внимание уделяется поиску универсальных средств фото-защиты, борющихся с эффектами широкого спектра электромагнитного излучения как снаружи, так и изнутри, системно. В этом отношении обнадеживающие клинические результаты показывают экстракты некоторых растений, а особенно — папоротника Polypodium leucotomos. Его фотозащитные свойства сравнительно неплохо изучены в лаборатории (in vitro) и живых системах (in vivo). Чтобы оценить эти свойства по достоинству, необходимо вспомнить механизмы действия света на кожу человека.
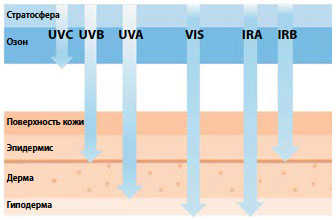 Рис. 1. Глубина проникновения в кожу лучей солнечного спектра [2]
Рис. 1. Глубина проникновения в кожу лучей солнечного спектра [2]
ВЛИЯНИЕ СОЛНЕЧНОГО ИЗЛУЧЕНИЯ НА КОЖУ ЧЕЛОВЕКА
По последним данным, кожу повреждают ультрафиолетовые (УФ) лучи типов А и В, ближнее инфракрасное излучение (ИК-А) и даже видимый свет (ВС), но глубина проникновения волн разной длины (рис. 1), молекулярные механизмы и клинические проявления их действия могут различаться [2].
Ультрафиолет — основной провокатор фотостарения и неоплазии
Коротковолновый, высокоэнергетический УФ типа С (100–280 нм) задерживается озоновым экраном, до земной поверхности доходит преимущественно УФ-А (315–400 нм) и немного УФ-В (280–315 нм). Это излучение абсорбируется кожными хромофорами, к которым относят меланин, белки, липиды, ДНК и РНК, ароматические аминокислоты и транс-урокановую кислоту — продукт распада гистидина. В результате в клетках запускается множество фотохимических реакций и вторичных взаимодействий. УФ-лучи типа А индуцируют образование мощных окислителей — активных форм кислорода (АФК) и азота, большое количество которых собственные антиоксидантные системы организма не в состоянии нейтрализовать. Лучи УФ-В в меньшей степени повинны в синтезе АФК, зато напрямую повреждают ДНК, меняют межклеточную цитокиновую сигнализацию и синтез адгезивных молекул, необходимых для прикрепления и перемещения клеток кожи.
Все это на уровне организма проявляется состояниями, которые можно условно разделить на 2 группы:
1) острые — покраснение и некроз (ожог), воспаление, иммуносупрессия;
2) хронические — канцерогенез и фотостарение, характеризующиеся появлением морщин и изменением цвета кожи.
В острых повреждениях повинны в основном более агрессивные лучи УФ-В, и именно с ними успешно справляется большинство косметических УФ-фильтров. Фотостарение связывают преимущественно с лучами типа А, которые проникают глубже и составляют в среднем 95% всего получаемого кожей солнечного излучения. Канцерогенным действием в конечном итоге обладает любой УФ.В основе хронических эффектов лежат такие процессы, как окислительный стресс, хроническое воспаление и ангиогенез, аномальное ремоделирование внеклеточного матрикса (ВМ), мутации ДНК и иммуносупрессия.
– Окислительный стресс и воспаление. Активные формы азота и кислорода окисляют белки, липиды мембран и ДНК, истощают пул антиоксидантов, модулируют сигнализацию по биохимическим путям, ответственным за воспаление, состояние ВМ, выживание и деление клеток. УФ-повреждения ДНК и окислительный стресс активируют транскрипционные факторы AP1 и NF-kβ, а они запускают цепь событий, ведущих к воспалению и канцерогенезу [2].
С другой стороны, повреждение хромосом и митохондрий часто вызывает программируемую гибель (апоптоз) фибробластов и кератиноцитов. АФК повышают экспрессию генов циклооксигеназы-2 (COX-2), производящей простагландин Е2. Это вещество привлекает к месту облучения иммунные клетки, запуская воспалительную реакцию. Вкупе с активацией синтазы оксида азота это ведет к расширению и гиперпроницаемости сосудов, отеку и аномальному ангиогенезу. Кроме того, УФ повышает уровни таких провоспалительных цитокинов, как интерлейкин-6 и фактор некроза опухолей (ФНО). Медиаторы воспаления и клеточный дебрис привлекают в зону облучения нейтрофилы и тучные клетки, что усугубляет ситуацию из-за высвобождения ими АФК, гистамина и других провоспалительных веществ.
– Ремоделирование ВМ. Под действием УФ подавляется активность трансформирующего ростового фактора β (TGF-β), который стимулирует синтез фибробластами коллагена. В то же время усиливается продукция матриксных металлопротеиназ (ММП), разрушающих белки ВМ и способствующих эластозу — отложению в дерме неполноценного эластина. Окислительный стресс ведет к изменениям морфологии фибробластов и нарушению выработки ими адгезивных молекул, необходимых для взаимодействий «клетка — клетка» и «клетка — ВМ».
– Повреждения ДНК. Лучи УФ-В повреждают ДНК напрямую, чаще всего «сшивая» тимины двух соседних нуклеотидов (димеризация пиримидиновых оснований), а также «разрезая» нити ДНК, «склеивая» их с разными белками, перекрещивая и т.п. Лучи УФ-А вредят ДНК опосредованно: генерируемые ими АФК чаще всего окисляют гуанин, и образующаяся молекула — 8-OH-dG — служит платформой для дальнейших мутаций (а заодно и общепризнанным маркером окислительного стресса). Излучение УФ-В ответственно за образование 8-OH-dG в меньшей степени. К самым частым УФ-индуцированным мутациям очень восприимчивы богатые тимином и гуанином теломеры — защитные «колпачки» на концах хромосом, играющие важную роль в процессах канцерогенеза и клеточного старения. Но особенно опасны мутации гена опухолевого супрессора p53, поскольку без этого контролера клетки приобретают устойчивость к апоптозу и могут размножаться, «не залечив» дефекты ДНК.Любой УФ повреждает не только хромосомную, но и митохондриальную ДНК, что ведет к усилению генерации АФК, нарушениям клеточного метаболизма и онкогенезу. Некоторые типы выпадения фрагментов (делеции) митохондриальной ДНК рассматривают в качестве потенциальных тканеспецифичных маркеров старения, а в случае кожи — маркеров суммарной УФ-экспозиции [3].
– Иммуносупрессия. Улавливание фотонов УФ-В кожной (и выделяемой с потом) транс-урокановой кислотой ведет к ее превращению в цисурокановую кислоту. Эта изомеризация служит сигналом к иммуносупрессии, частично опосредованной истощением пула эпидермальных клеток Лангерганса и дегрануляцией тучных клеток [4]. В зависимости от полученной дозы облучения клетки Лангерганса, выполняющие в коже антигенпредставляющие функции, либо устремляются из кожи на выбраковку в лимфоузлы, либо подвергаются апоптозу. Невыполнение этими клетками своих обязанностей ведет к клональной анергии Т-хелперов типа 1, т.е. к утрате ими способности реагировать на некоторые антигены. Вкупе с другими процессами [5] это повышает риск развития опухолей и инфекций кожи. УФ-индуцируемая иммуносупрессия может проявляться и системно, что связывают с выделением противовоспалительного интерлейкина-10.
ИНФРАКРАСНОЕ ИЗЛУЧЕНИЕ И ВИДИМЫЙ СВЕТ НЕ ТАК БЕЗОБИДНЫ, КАК СЧИТАЛОСЬ
ИК-излучение проникает глубоко и давно используется в небольших дозах для лечения патологий опорно-двигательного аппарата и кожи. Однако выяснилось, чтo пул каротиноидов истощается под действием ИК-А и ВС (особенно сине-фиолетовой области) так же, как и в случае УФ. Значит, свет этих диапазонов провоцирует образование АФК и свободных радикалов, т.е. тоже вносит вклад в фотостарение. Кроме того, ИК-А и ВС стимулируют синтез металлопротеиназ ММП-1 и ММП-9, одновременно подавляя выработку коллагена. ИК-А активирует ангиогенез, рекрутирует тучные клетки и сокращает пул клеток Лангерганса, а ВС вызывает немедленное потемнение кожного пигмента, которое выражено даже сильнее и держится дольше, чем если бы было спровоцировано УФ [2]. Считалось, что отражать атаки фотонов ИК и видимого света могут лишь минеральные светофильтры, которые не всем подходят и не столь безопасны, как хотелось бы. Но недавно было показано, что отпор широкому диапазону солнечного излучения могут дать и вещества, входящие в состав экстракта Polypodium leucotomos.
 Рис. 2. Эпифитный папоротник Polypodium leucotomas (Phlebodium aureum)
Рис. 2. Эпифитный папоротник Polypodium leucotomas (Phlebodium aureum)
ПАПОРОТНИК P. LEUCOTOMOS: МЕДИЦИНСКАЯ БИОГРАФИЯ И АКТИВНЫЕ КОМПОНЕНТЫ
Polypodium leucotomos — это устоявшееся, традиционное название, если же руководствоваться новыми систематическими данными, то ему предпочитают Phlebodium aureum (флебодиум золотистый). В испаноязычных странах распространено название calaguala, а в португалоязычных — samambaia. Предки современных папоротников одними из первых адаптировались к жизни на суше, выработав многоуровневые системы защиты от агрессивного солнечного излучения. Сейчас эти растения распространены повсеместно и крайне разнообразны: среди них есть и травянистые, и древовидные, и эпифитные (растущие на деревьях) формы. Однако об их древнем происхождении напоминают споровое размножение и особенности строения: «лист» папоротника — не лист вовсе, а вайя — уплощенная система ветвей с прообразами листовых пластин.
P. leucotomos изначально обитал во влажных лесах Центральной и Южной Америки, предпочитая эпифитный образ жизни (рис. 2). Европейцы познакомились с этим папоротником на исходе XVIII в., после знаменитой ботанической экспедиции Иполито Руиса [6, 7].
В центральноамериканской народной медицине флебодиуму отводилась почетная роль панацеи: в свежем виде его вряд ли употребляли (много синильной кислоты), а вот отваром лечили болезни кожи, сердца и дыхательной системы. «Чистить» кровь с помощью папоротникового чая начали еще индейцы майя и продолжают до сих пор гондурасцы. Кашель и ментальные проблемы до эпохи Возрождения в Европе лечили ближайшей родственницей флебодиума — многоножкой обыкновенной. Интересно, что в современной медицине с помощью коммерческих экстрактов P. leucotomos, появившихся в 1970-х, пытаются бороться примерно с тем же спектром состояний — кашлем, болезнью Альцгеймера, а также дерматологическими патологиями и опухолями. Особенно много публикаций посвящено фотозащитным свойствам флебодиума, которые определяются уникальным химическим составом его «листьев» [4, 8].
В экстракте папоротника P. leucotomos (ЭП) обнаружены:
– фенольные кислоты (феруловая, кофейная, ванилиновая, кумаровая, хлорогеновая и др.) — основные фотозащитные вещества ЭП, известные своей антиоксидантной активностью; особенно высока эта активность у феруловой кислоты, улавливающей УФ-фотоны, и кофейной, блокирующей перекисное окисление липидов и нейтрализующей оксид азота;
– флавоноиды — растительные пигменты, обладающие антиоксидантными, противовоспалительными и противоопухолевыми свойствами;
– сахара (фруктоза, манноза, глюкоза).
МОЛЕКУЛЯРНЫЕ И КЛЕТОЧНЫЕ ЭФФЕКТЫ ЭКСТРАКТА P. LEUCOTOMOS.
Влияние ЭП на живые организмы изучали более 40 лет и, конечно, первыми экспериментальными объектами были культуры клеток и лабораторные животные [10]. С их помощью удалось показать, что ЭП не проявляет мутагенных или токсических свойств при приеме внутрь даже в дозе 200 мг/кг [11]. Это позволило приступить к изучению механизмов влияния ЭП непосредственно на организм человека. Выяснилось, что фотозащитное действие P. leucotomos обусловлено антиоксидантными, антимутагенными, противовоспалительными и иммуномодулирующими эффектами, а также регуляцией построения ВМ (табл. 1, рис. 3, 4).Таким образом, содействуя поддержанию нормальной архитектуры кожи и правильной работе ее основных элементов, ЭП может препятствовать получению солнечных ожогов, фотостарению и онкогенезу [12, 13]. Но проявились ли как-то молекулярные эффекты ЭП в макроскопическом масштабе — на уровне человеческого организма, в рамках клинических исследований?
Таблица 1. Фотозащитные эффекты экстракта P. leucotomos [2, 4, 5]. Разделение не лишено условности, поскольку
эти эффекты иногда взаимообусловлены и могут затрагивать одни и те же сигнальные пути

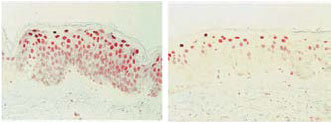 Рис. 3. Экстракт P. leucotomos предотвращает накопление УФ-повреждений ДНК в клетках эпидермиса.
Рис. 3. Экстракт P. leucotomos предотвращает накопление УФ-повреждений ДНК в клетках эпидермиса.
Микрофотографии биоптатов кожи через 24 ч после симулированного солнечного облучения:
слева — без предварительного приема ЭП, справа — после двукратного приема суточной дозы ЭП (Fernblock®).
Число клеток с пиримидиновыми димерами (окрашены красным) составляло в среднем 74,7
и 43,7 клетки на мм эпидермиса соответственно [17]
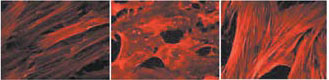
Рис. 4. Экстракт P. leucotomos предотвращает УФ-индуцированные изменения морфологии человеческих фибробластов.
Слева — актиновые волокна цитоскелетав норме, в центре — после УФ-А-облучения,
справа — после УФ-А-облучения с предварительной обработкой клеток ЭП (1 мг/мл) [18]
ПРИМЕНЕНИЕ ЭКСТРАКТА ПАПОРОТНИКА В ДЕРМАТОЛОГИИ: КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ И ПЕРСПЕКТИВЫ
Получить представление о доказательной базе, обосновывающей местное и внутреннее применение ЭП в дерматологии, поможет табл. 2. Исследования показали, что активные вещества ЭП легко проникают в кожу при местном применении и хорошо усваиваются при приеме внутрь. Поэтому на основе экстракта P. leucotomos создаются средства как для наружного, так и для внутреннего применения. Пока их не относят к лекарственным препаратам, а значит, сложно говорить о четких схемах применения при тех или иных состояниях. Результаты клинических исследований позволяют, однако, рекомендовать для фотозащиты здорового человека стандартизованный ЭП из расчета 7,5 мг/кг/сут. Соответственно, взрослым средней комплекции часто назначают по 240 мг ЭП 1–3 р/сут [7, 9]. В составе косметических средств ЭП ингибирует покраснение кожи при содержании от 0,1% (вес/объем) [2]. Анализ опубликованных в 1972–2014 гг. статей, посвященных влиянию ЭП на человеческий организм, не выявил серьезных нежелательных реакций у испытуемых. Лишь 1,6% пациентов заявили о легких или умеренно выраженных кишечном дискомфорте и зуде. Анализ охватил исследования, в которых ЭП принимали перорально в дозе 120–1200 мг/сут [7, 11].
Таблица 2. Клинические исследования фотозащитного действия ЭП [7, 9, 11, 14–16]
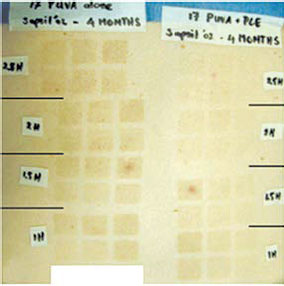 Рис. 5. Экстракт P. leucotomos снижает выраженность фото- токсической реакции и последующей пигментации в период ПУВА-терапии.
Рис. 5. Экстракт P. leucotomos снижает выраженность фото- токсической реакции и последующей пигментации в период ПУВА-терапии.
Слева от центральной оси — пигментация через 4 мес после сеанса ПУВА, справа — то же, но в случае предварительного приема тем же пациентом ЭП.
Квадраты — зоны облучения УФ-А разной интенсивности, расположены в сравниваемых случаях зеркально [19]
Так в каких же случаях дерматолог может рекомендовать средства с ЭП?
– Для ежедневной защиты кожи от солнца. Она особенно важна, если пациент светлокож, генетически предрасположен к раку кожи или если ему предстоят повышенные солнечные «нагрузки»: работа или занятия спортом вне помещений, путешествия, прием фотосенсибилизаторов и т.п. Информировать пациентов о важности комплексной фотозащиты необходимо в первую очередь из-за коварства солнечных повреждений: ожог и покраснение — неприятности преходящие, а вот накапливающиеся молекулярные поломки и изменения клеточной сигнализации через годы проявляются морщинами, пигментными пятнами и новообразованиями, не все из которых безобидны. Около 86% меланом и 90% базально клеточных и плоскоклеточных карцином связывают именно с солнечным облучением. Ежегодно этих опухолей выявляется больше, чем злокачественных новообразований груди, простаты, легких и толстой кишки вместе взятых! Дополнительную мотивирующую информацию можно найти на сайте The Skin Cancer Foundation (
www.skincancer.org).
– Для снижения фототоксичности и повышения эффективности некоторых медицинских процедур. Например, ПУВА-терапии (УФ-А-облучение, дополненное приемом фотосенсибилизаторов из класса псораленов) (рис. 5), терапии УФ-B-лучами узкого спектра (NB-UVB) и фотодинамической терапии. Первый тип фототерапии применяют, в частности, для лечения псориаза, второй — для восстановления пигментации при витилиго (рис. 6), третий — для лечения актинического (старческого) кератоза и других новообразований. ЭП может быть эффективен как минимум в качестве адъюванта.
– Для предупреждения идиопатических фотодерматозов («солнечных аллергий»). К таким состояния мотносят солнечную крапивницу, полиморфную световую сыпь (ПСС), актинические дерматит и пруриго, подострую кожную красную волчанку [7]. Эффективность ЭП подтверждена пока только по отношению к ПСС.
– Для профилактики усугубления гиперпигментации при мелазме и после кожных воспалений. Поствоспалительным потемнением кожи могут заканчиваться эпизоды высыпаний при опоясывающем герпесе, волчанке, псориазе, акне и т.д. Поскольку препараты с ЭП безопасны и показывают профилактическую и терапевтическую эффективность в отношении ряда состояний [7, 9, 11, 14–16], вполне вероятно, что из пищевых добавок они скоро превратятся в лекарственные средства. Для этого им предстоит пройти дополнительные, более масштабные клинические исследования, в которых необходимо найти оптимальные дозировки и схемы употребления ЭП. Однако здесь нужно вспомнить, что эффективность растительных препаратов радикально меняется в зависимости от условий выращивания, способа переработки и очистки сырья, вспомогательных веществ и условий хранения. Лабораторные и клинические исследования, выявившие фотозащитные свойства P. leucotomos, проводились лишь с одним, получаемым по запатентованной технологии, экстрактом папоротника — Fernblock®. Поэтому нет никакой гарантии, что другие экстракты флебодиума золотистого имеют то же количество и те же пропорции фенольных компонентов, а значит, и такую же эффективность — от биологически активных добавок этого просто не требуют [16].
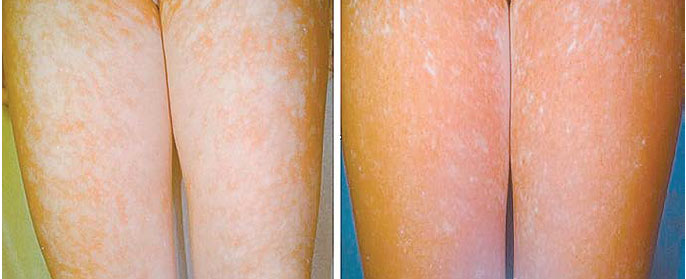 Рис. 6. Восстановление пигментации кожи у пациента с витилиго:
Рис. 6. Восстановление пигментации кожи у пациента с витилиго:
слева — до курса NB-UVB-терапии, дополненного приемом ЭП,
справа — после 6 мес терапии [20]
СРЕДСТВА ДЛЯ КОМПЛЕКСНОЙ ФОТОЗАЩИТЫ НА ОСНОВЕ FERNBLOCK®
Испанский концерн Industrial Farmaceutica Cantabria (IFC) разработал технологию Fernblock® совместно с дерматологами и фотобиологами Гарвардской медицинской школы, в числе которых был и знаменитый Томас Фицпатрик. Производитель Fernblock® гарантирует, что получает свой препарат низкотемпературной водной экстракцией из растений, выращенных без пестицидов и прошедших тщательный отбор, а качественный и количественный состав экстракта контролирует по принятым фармацевтическим стандартам [16].
Fernblock® входит в состав фотозащитных продуктов, выпускаемых под брендом Heliocare®. В косметических средствах и капсулах для перорального применения ЭП дополнен другими антиоксидантами — экстрактом зеленого чая, различными каротиноидами и витаминами.
В косметических продуктах содержатся также увлажнители и светофильтры. Эти средства адаптированы для разных типов и оттенков кожи и обеспечивают несколько уровней УФ-защиты — от повседневной профилактической до терапевтической (линейки Ultra и Heliocare 360°, последняя предохраняет даже от ИК и ВС). Однако возможности даже лучшей местной защиты ограничены, и задачу борьбы с эффектами солнечного излучения в глубоких слоях кожи способны решить только системные фотопротекторы. Капсулированный экстракт P. leucotomos — своеобразный «внутренний светофильтр», который страхует от ошибок, почти неизбежных при нанесении внешней защиты. Более того — и это вне зависимости от способа применения, — действие Fernblock® распространяется на настройку иммунных механизмов, за что и получило название «иммунофотопротекция».
ЗАКЛЮЧЕНИЕ
Экстракт папоротника уникален тем, что выводит из строя сразу несколько молекулярных механизмов, с помощью которых солнце разрушает нашу кожу, а иногда и жизнь. Его активные вещества защищают клеточные компоненты и модулируют работу важнейших сигнальных путей, определяющих судьбу клеток и баланс иммунных процессов в коже. Эти эффекты, направленные на предотвращение солнечных ожогов, фотостарения и канцерогенеза, благодаря внушительному списку исследований можно считать доказанными. Целесообразность и способы применения ЭП при различных клинических состояниях пока не регулируются FDA и похожими европейскими организациями, хотя весомые предпосылки для перевода стандартизованного ЭП в разряд лекарственных средств уже есть. Но в любом случае авторы исследований ЭП стараются донести до врачей и пациентов важную мысль: даже такое замечательное средство ни в коем случае не заменяет, а удачно дополняет старые добрые солнцезащитные фильтры, очки, непрозрачную одежду и чувство меры.
Скачать статью в pdf







